Pilotez la gestion des risques de vos DM et DMDIV
ISO 14971, IEC 62304, l’aptitude à l’utilisation CEI 62366 et la conception de vos dispositifs médicaux.
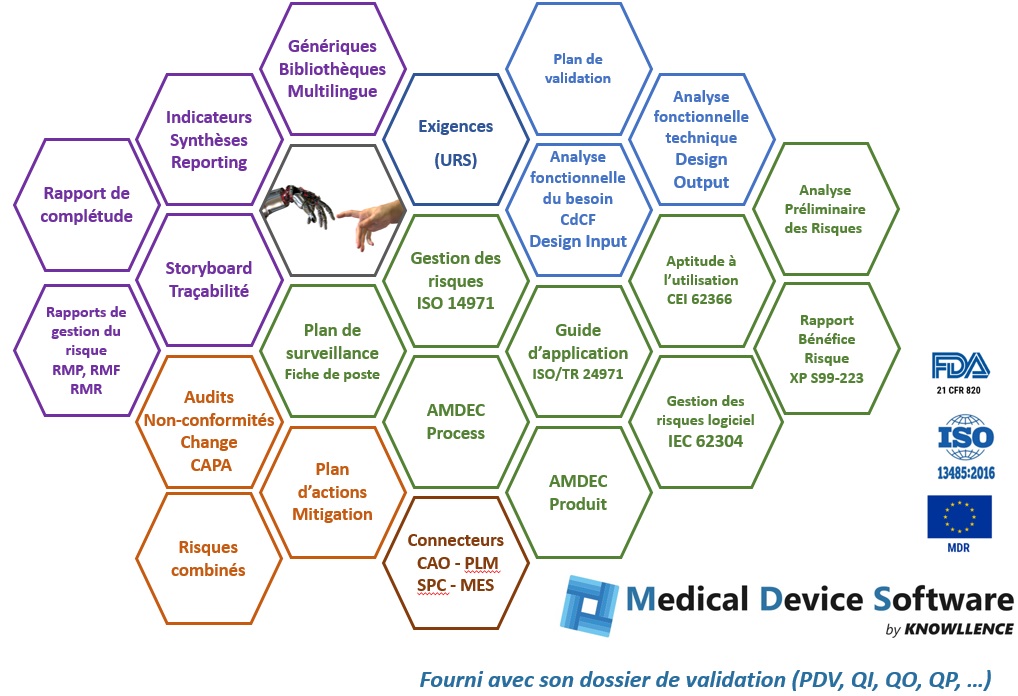

Les logiciels modulaires de Medical Device Software offrent aux équipes Affaires Réglementaires et Conception les avantages suivants :
- Structurer les démarches d’analyses fonctionnelles, d’aptitude à l’utilisation, d’AMDEC et d’analyse de risque
- Sécuriser les audits (conformité, complétude, up-to-date, traçabilité, …)
- Assurer la cohérence du dossier d’aptitude à l’utilisation CEI 62366 et du rapport de gestion des risques ISO 14971
- Analyser les risques de vos composants logiciels selon l’IEC 62304
- Alimenter sereinement votre dossier de marquage CE
- Gagner beaucoup de temps sur les mises à jour, la gestion des variantes de DM, l’édition des reporting…
- Gérer la complexité des projets
- Impliquer et motiver les équipes
- S’intégrer dans votre SMQ selon ISO 13485 ou référentiel FDA (21 CFR part 820)
Les modules logiciels pour les dispositifs médicaux
Medical Device Software est composé de différents modules logiciels qui partagent les données de façon à éviter toute double saisie et tout risque de divergence :
- RM 14971 : gestion du risque selon l’ISO 14971 et IEC 62304
- Need pour recueillir la voix du client et structurer le « vrai » besoin avec l’analyse fonctionnelle et préparer votre dossier d’aptitude à l’utilisation en définissant profils et cas d’utilisation selon CEI 62366. Identifier vos Design Input.
- Structure pour croiser besoins et nomenclature technique, optimiser la (re)conception des dispositifs médicaux, identifier vos fonctions d’interface. Définir vos Design Output.
- FMEA pour les études AMDEC Produit et/ou AMDEC process, plans de surveillance, synoptique de fabrication, fiches de poste, …
Des logiciels performants pour les fabricants de DM !
Avec Medical Device Software, vous disposez d’une solution permettant :
- de réaliser vos analyses de gestion des risques ISO 14971 selon le point de vue des affaires réglementaires,
- d’alimenter, en cohérence, le dossier d’aptitude à l’utilisation CEI 62366,
- de réaliser les analyses fonctionnelles et les études AMDEC Produit et AMDEC Process,
- et de garantir durablement la cohérence globale de ces données.
Selon votre contexte, et vos besoins, vous êtes libre de n’utiliser qu’un module, ou au contraire, d’exploiter le partage, la cohérence des données et les automatisations entre les différents modules au sein de cette base de données unique.
Faciliter la collaboration Affaires réglementaires et Conception
Medical Device Software est un ensemble de logiciels pour piloter la gestion des risques ISO 14971, l’aptitude à l’utilisation CEI 62366 et la conception de vos dispositifs médicaux.
Medical Device Software est une solution logicielle répondant aux attentes
- des Services Affaires réglementaires avec la Gestion des risques ISO 14971
- des Concepteurs avec les Analyses fonctionnelles (du besoin et technique) et AMDEC
L’objectif : le partage des informations, la mutualisation et la capitalisation des données Aptitude, Conception et Risques de vos dispositifs médicaux.
Apporter de la cohérence entre le risque patient et les AMDEC Process (PFMEA)
Vos situations dangereuses sur les patients peuvent être liées aux défaillances identifiées lors de la production. Cela permet d’éviter les redondances ou incohérences sur la prise en compte d’un problème commun aux différentes étapes de conception/ industrialisation du produit (et de ses variantes).
Medical Device Software propose un plan d’action commun entre vos analyses de risques 14971 et vos différentes AMDEC. Le pilotage des actions est ainsi réalisé de manière transverse ce qui garantit une affectation réaliste des charges et des mesures aux parties prenantes.
Lors d’un retour post-marché lié à un incident sur un utilisateur vous pouvez ainsi prendre facilement les mesures requises dans votre plan de surveillance et identifier les risques process associés.
Medical Device Software s’inscrit ainsi parfaitement dans le cadre des exigences en matière de système de management de la qualité (SMQ) de l’ISO 13485.
Les atouts de Medical Device Software : démarrez facilement
- La reprise d’existant depuis vos outils bureautiques est notre affaire si vous le souhaitez. Confiez-nous cette tâche fastidieuse : voir Récupération des études existantes.
- Medical Device Software est déjà configurée prête à l’utilisation selon notre expertise en terme d’informatisation des normes, bonnes pratiques et référentiels. Notre solution est aussi la plus paramétrable du marché, nous pouvons l’adapter à vos standards internes de gestion des risques en particulier.
- Profitez des bibliothèques de contenu déjà intégrées, que vous pourrez modifier et enrichir : dangers, séquences d’événements, dommages sur l’homme, sur les équipements et sur l’environnement, etc. Vos référentiels spécifiques sont ainsi renseignés et capitalisés au fil de l’eau : situations dangereuses, actions à mener, …
- Commencez par le ou les modules logiciels adaptés à votre problématique actuelle.
Gagnez durablement du temps et de l’efficacité
- A chaque nouveau projet de dispositif médical, réutilisez vos bibliothèques, les génériques éventuels, et les possibilités de gérer les variantes de Dispositif Médical.
- Les données post-market sont facilement identifiées grâce à notre système unique et automatique de traçabilité des données. En un clic, vous savez qui a fait quoi, quand et comment.
- Vos projets peuvent être gérés dans les différentes langues pertinentes de votre activité : à la fois en terme d’interface et de documents et (surtout) de façon simultanée, au niveau de chaque donnée.
- Medical Device Software facilite la collaboration entre les parties prenantes, par son utilisation en direct pendant les séances de travail comme véritable outil graphique d’animation, et par la gestion fluidifiée des plans d’actions.
- Vos documents sont toujours à jour, standardisés et faciles à communiquer : cahiers des charges, études AMDEC Produit et/ou Process, rapport de gestion des risques, données permettant d’alimenter le dossier d’aptitude à l’utilisation, synthèse des actions et des évolutions du niveau de risque.
- Limitez le stress lors des audits inopinés : la cohérence des données est assurée !
Une solution validée
Pour répondre aux principales exigences réglementaires et normatives des référentiels français, européens, nord-américains et internationaux, nous vous fournissons un logiciel qualifié et validé pour l’analyse de vos risques selon l’ISO 14971.
Aussi nous élaborons et vous fournissons un dossier complet de validation à chaque sortie de version Medical Device Software pour le module RM 14971.
